Alimentation et neuromédiateurs cérébraux
Pr D. RIGAUD - Président d'Autrement
1. La base : le cerveau archaïque et ses liens avec le reste du cerveau
Le cerveau est organisé en zones fonctionnelles, les unes très anciennes, les autres plus récentes. Il y a ainsi un cerveau « primitif », « archaïque » qui est, anatomiquement, à la fois le plus central et le plus profondément situé (Figure 1).
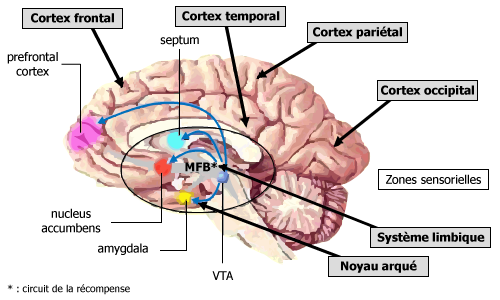
Le cerveau « archaïque » (système limbique) est entouré et coiffé, de l’arrière vers l’avant, des zones sensorielles (olfaction, vision, gustation, audition), du cortex pariétal pour les zones sensitives (toucher, sensations en provenance des viscères), du cortex frontal (zones motrices, pour les mouvements), du cortex temporal (pour les fonctions cognitives, de mémorisation et pour la vision) et du cortex préfrontal, où se trouvent les zones de motivation.
Le cerveau « archaïque » est composé de différents centres : hypothalamus, noyau accumbens, noyau arqué… zones où sont pilotées les émotions, l’humeur, les motivations profondes et les répétitions d’action. C’est dans cette zone limbique que se trouve l’hypothalamus, qui régule la prise alimentaire, les grandes fonctions endocriniennes, la sexualité et en partie les émotions.
Les deux « cerveaux », le cerveau archaïque et les zones qui le coiffent : cortex préfrontal, temporal, frontal, pariétal et occipital, dialoguent entre eux, mais aussi avec le reste du corps (les viscères : poumons, tube digestif, muscles…).
Ainsi un désir alimentaire fait-il naître un processus de reconnaissance (dans les zones de mémoire), un processus de motivation, via l’hypothalamus puis les zones préfrontales, une série d’actions (je vais chercher ma nourriture, je la prépare), enfin des sensations (zone pariétale) et des émotions (à nouveau dans le système limbique). Le tout est intégré et mémorisé, pour être utilisé les fois suivantes.
C’est ceci qui définit le comportement alimentaire et permet la régulation de la prise alimentaire. C’est aussi ce qui permet de manger « naturellement », c’est à dire en fait sans avoir à « se prendre la tête comme les premières fois ». C’est le même processus qui est à l’œuvre quand on fait du vélo. Les 1ères fois sont plus que difficiles. Rien n’est simple, ni l’équilibre, ni pédaler, ni avancer droit. Puis le cerveau « apprend », c’est à dire intègre, met en mémoire et garde tout ce processus complexe sous une rubrique « vélo ». Par la suite, dès que l’on veut faire du vélo, le « logiciel vélo » s’ouvre et toutes les opérations nécessaires pour pédaler se déroulent sans qu’on ait à y penser (« on sait faire »). Mais, pour ceci, il a fallu une motivation (pour apprendre), une intégration (garder l’équilibre, pédaler, tenir bien ses mains et ses bras, pouvoir freiner….), une prise en compte du rendu « sensitif » (la vitesse, l’éloignement du corps du sol, le déséquilibre, la vision….). Il a fallu encore que tout ceci soit jugé « positif », à la fois émotionnellement (« c’est super de faire du vélo, ça m’excite ») et cognitivement, ici sociétalement (« c’est jugé comme bien par les gens de savoir faire de la bicyclette »).
Pour l’alimentation, les mêmes systèmes sont impliqués. Au niveau du système limbique, une valeur hédonique est donnée à l’ingestion d’aliments. Cette note hédonique s’inscrit sur une gamme allant de « c’est super bon » à « c’est infect », mais aussi sur une gamme cognitive (apprise par l’intelligence) allant de « c’est bon pour la santé » à « c’est très dangereux pour la santé ». Chaque aliment, chaque repas, chaque heure de repas a ainsi sa note. Tout ceci est intégré et sert à rendre naturel le fait de manger à midi (ou 13 h), 3 plats (plutôt que 6), chaud (plutôt que froid), salé (plutôt que sucré)…
Bien sûr, dans ce processus, les besoins nutritionnels de l’organisme sont pris en compte.
Le système limbique comporte des zones où sont secrétés des neuromédiateurs particuliers (les neuromédiateurs sont les hormones du cerveau). Les neuromédiateurs sont des outils de communication entre cellules nerveuses. Comme les « circuits électrochimiques entre neurones sont ultrarapides, les neuromédiateurs servent plutôt, eux, à donner le « la », l’ambiance, le contexte. Ils sont utilisés pour « stimuler » ou « inhiber », « inciter » ou « refreiner », « exciter » ou « déprimer »…. Parmi ces neuromédiateurs, deux jouent un rôle essentiel dans la modulation des fonctions d’incitation et de répression : la sérotonine et la Dopamine. Mais il en est d’autres, tout aussi importants, l’endorphine, les cannabinoïdes, les catécholamines (l’adrénaline et la noradrénaline).
De façon malgré tout un peu simpliste, on peut résumer ceci de la façon suivante :
- La sérotonine a sous son contrôle l’humeur, le sommeil, la mémorisation, la cognition (faire des liens de type « réfléchi ») et l’état d’excitation (le contraire de la dépression).
- La Dopamine a sous son contrôle la motivation, le plaisir, la répétition des comportements, euphorie et pulsions.
C’est ce qui explique que :
- La sérotonine soit à la fois antidépressive, stimulante voire excitante et motivationnelle (« il faut que je fasse telle chose, parce que c’est valorisant…. »)
- La Dopamine soit un des moteurs de l’addiction, des pulsions, du désir et du plaisir, mais aussi du manque (addictions).
Ces deux neuromédiateurs sont fabriqués au sein du cerveau à partir de molécules (« précurseurs »), la tyrosine pour la Dopamine et le tryptophane pour la sérotonine. Or la tyrosine et le tryptophane sont 2 acides aminés essentiels (voir le sujet «protéines»). Nous les tirons quasi exclusivement de notre alimentation, puisque l’organisme humain ne sait pas les fabriquer. Ce sont les protéines d’origine animale qui les contiennent (viande, poisson, œufs, lait, laitages et fromages).
Les protéines contenues dans nos aliments sont digérées par les enzymes digestives et les acides aminés qui les composent libérés. Une fois dans le sang, la tyrosine et le tryptophane se lient à des « porteurs » et sont, sur ces porteurs, en compétition avec d’autres acides aminés (les acides aminés dit neutres). Les aliments sucrés-gras, en induisant une montée de glycémie (taux de sucre dans le sang) permettent de libérer factuellement ces autres acides aminés, permettant ainsi le transport jusqu’au cerveau de la tyrosine et du tryptophane. Ceux-ci passent la barrière qui sépare le sang du liquide céphalo-rachidien (le liquide nourricier du sang) au niveau du noyau arqué (voir la figure 1). Diffusant dans le système limbique, la tyrosine et le tryptophane permettent la synthèse de Dopamine et de sérotonine.
2. Avons-nous des preuves qu’apporter tyrosine et le tryptophane permette de changer le comportement alimentaire ?
Les preuves chez le rat et la souris sont assez convaincantes. Chez le rat, une supplémentation en tryptophane permet d’augmenter ses concentrations intracérébrales dans certaines zones du cerveau, preuve que ça va bien au cerveau.
Chez l’homme, il a été montré que des apports en protéines différents permettaient d’obtenir des concentrations plasmatiques de certains acides aminés (a.a.) différents. De plus, le rapport tryptophane ou tyrosine sur les a.a. neutres changeait également. Parmi les protéines alimentaires, certaines protéines animales induisent plus de satiété que d’autres : lorsque le petit déjeuner est enrichi en protéines animales, l’apport énergétique du déjeuner de midi peut être diminué de 20 % (protéines du lait et de la viande), comparée à un petit déjeuner sans apport protéique ou contenant de l’œuf ou de la caséine. En cas de déjeuner riche en protéines, la sensation de faim est plus basse 3 heures plus tard, comparé à un repas pauvre en protéines. La réduction des apports, dans ces études, était corrélée avec la faim. Une autre étude de la même équipe a confirmé ces résultats.
Par ailleurs, l’inhibition de la recapture de la sérotonine (IRS) par des médicaments (par exemple les antidépresseurs de type sérotoninergique), peut améliorer significativement le comportement alimentaire : moins de sensation de faim, moins de crises de compulsions alimentaires (« binge eating »), moins d’anxiété et moins d’état dépressif. Cependant, ces améliorations semblent être de relativement courte durée (elles ne durent que le temps de la prise et ne se maintiennent pas au-delà de 3 mois). Ceci pourrait s’expliquer, chez les malades boulimiques ou compulsives, par un défaut de synthèse de sérotonine, au bout de plusieurs semaines. En effet, l’alimentation de ces malades est en règle assez pauvre en tyrosine et tryptophane, compte tenu de l’exclusion volontaire des viandes, fromages, lait, œufs chez beaucoup d’entre elles.
Il a été prouvé qu’une supplémentation en tryptophane pouvait améliorer le comportement alimentaire, au moins chez certains patients, dans certaines conditions :
- Dans la boulimie (associant crises compulsives, vomissements provoqués et poids normal), on a observé que provoquer une déplétion aiguë en tryptophane conduisait à une aggravation des symptômes alimentaires et favorisait une altération de l’humeur, y compris sous médicament antidépresseur de type IRS (17,18).
- Chez des patients obèses compulsifs, la même déplétion aiguë en tryptophane peut induire une augmentation des ingesta d’aliments sucrés-gras. Dans l’étude de Gendall et Joyce, 9 femmes ayant des compulsions alimentaires ont été étudiées après 3 types de repas différents :
le rapport tryptophane+tyrosine sur a.a. neutres (RTT/N) était plus élevé après le repas riche en glucides énergétiques et protéines (féculents + viande).
Dans le même temps, le besoin de compulsions alimentaires et les fringales pour les aliments sucrés-gras diminuaient (P=0,07).
- Chez des malades anorexiques mentales en cours de renutrition, Erlisch et al ont observé une concentration plasmatique de tryptophane et tyrosine basse, y compris après restauration du poids normal. Ils suggèrent le rôle de ce déficit dans les crises compulsives alimentaires qui émaillent souvent l’évolution vers la guérison (au moins un tiers des cas).
Dans une étude récente, 102 malades ont été inclus dans une étude randomisée en double insu, comparant la supplémentation en tyrosine et tryptophane (STT) à une supplémentation « classique » en protéines de bonne valeur biologique (SP). Le but était de savoir si la STT permettait une plus grande perte de poids à moindre risque de compulsions alimentaires chez des patients en surpoids ou obèses. Tous les patients avaient les mêmes apports en calories et protéines (le même régime était prescrit). L’étude a duré 3 mois Sous STT, les malades ont eu une plus grande amélioration de leur qualité de vie (P<0,01), une moins grande anxiété (P<0,03), une humeur moins dépressive (P<0,01) et un comportement alimentaire plus normal (P<0,05) avec moins de troubles du comportement alimentaires (8% vs 19%, P<0,05) que les patients sous SP. Après 3 mois, sous STT, les pertes de poids (-10,6 + 5 kg vs SP : -8,3 + 4 kg, P<0,01), de masse grasse (-6,9 + 3 vs -5,8 + 2 kg, P<0,05) et de tour de taille (-11,6 + 6 cm vs -7,3 + 5 cm, P<0,01) étaient plus grandes que sous SP. Cette étude suggère donc bien qu’une supplémentation en tyrosine et tryptophane de 3 mois permet une plus grande perte de poids, une meilleure qualité de vie et un comportement alimentaire plus normal que lorsqu’une diète protéique « classique » est donnée.
3. Avons-nous des preuves qu’apporter tyrosine et le tryptophane permette de changer l’humeur ?
Si l’on sait depuis longtemps que les inhibiteurs de la recapture de la sérotonine ont un effet antidépresseur chez les patients ayant un trouble du comportement alimentaire (38,39), il n’y a pas d’étude publiée sur les effets anxiolytique et antidépresseur d’une supplémentation en tryptophane et tyrosine. L’étude ci-dessus confirme que c’est possible. Mais il ne serait pas raisonnable de penser que cette supplémentation serait plus efficace qu’un traitement antidépresseur médicamenteux. En revanche, il y a tout lieu de penser que chez des malades se nourrissant mal, avec des apports en protéines animales insuffisant, cette supplémentation pourrait éviter l’effet d’épuisement des effets du traitement antidépresseur. Cette résistance pourrait en effet n’être que le reflet d’une alimentation appauvrie en tyrosine et tryptophane.
Récemment, une étude en double insu a été effectuée chez 35 sujets, les uns avec un haut (n=17) et les autres (n=18) avec un bas niveau de stress. Cette étude comparait les effets à court terme (24 h) d’un hydrolysat de protéines d’œuf à celui de protéines animales « standard » : le premier augmentait la disponibilité cérébrale du tryptophane, diminuait la tendance dépressive et anxieuse et donnait un plus fort sentiment de dynamisme chez les sujets les plus stressés. Dans une étude épidémiologique, Voracek et al ont montré que le risque de suicide au sein de différents pays était inversement proportionnel aux apports présumés en tryptophane dans ces pays.
4. Conclusion
Tyrosine et tryptophane sont deux acides aminés précurseurs de deux neuromédiateurs impliqués à la fois dans les pulsions, le plaisir, la répétition, la mémorisation, l’humeur… et l’alimentation, qui fait intervenir tout ceci.
Chez des personnes dont l’alimentation est insuffisante en tyrosine et tryptophane (insuffisance de protéines animales), ces déficits peuvent induire des défaillances de synthèse de sérotonine et Dopamine, défaillances qui peuvent être responsables de troubles de l’humeur, du sommeil et de pulsions alimentaires.
5. Bibliographie
1 Brandacher G et al. Bariatric surgery cannot prevent tryptophan depletion due to chronic immune activation in morbidly obese patients. Obes Surg. 2006 May;16(5):541-8
2 Bruce KR et al. Impact of acute tryptophan depletion on mood and eating-related urges in bulimic and nonbulimic women. J Psychiatry Neuroscience 2009; 34 : 376-82.
3 Cavaliere H, Medeiros-Neto G. The anorectic effect of increasing doses of L-tryptophan in obese patients. Eat Weight Disord 1997 ; 2 : 211-215.
4 Choi S et al. Meal ingestion, amino acids and brain neurotransmitters: effects of dietary protein source on serotonin and catecholamine synthesis rates. Physiol Behav. 2009 ; 98 : 156-62.
5 Downe KA et al. Restraint, hunger, and disinhibition following treatment for binge eating disorder. Int J Eating Disorder 2009; 42 : 498-504.
6 Ehrlich S et al. Aromatic amino acids in weight-recovered females with anorexia nervosa. Int J Eat Disord 2009 ; 42 : 166-72.
7 Fernstrom JD et al. Diurnal variations in plasma concentrations of tryptophan, tyrosine, and other neutral amino acids: effect of dietary protein intake. Am J Clin Nutr 1979 ; 32 : 1912-22.
8 Gendall KA et al. Meal-induced changes in tryptophan/LNAA ratio: effects on craving and binge eating. Eat Behav. 2000 Sep;1(1):53-62.
9 Goossens L et al. Relations of dietary restraint and depressive symptomatology to loss of control over eating in overweight youngsters. Eur Child Adolesc Psychiatry 2010; 19 : 587-96.
10 Markus CR et al. Effect of tryptophan-rich egg protein hydrolysate on brain tryptophan availability, stress and performance. Clin Nutr 2010; Feb 16
11 Markus CR. Dietary amino acids and brain serotonin function; implications for stress-related affective changes. Neuromolecular Med. 2008;10 : 247-58.
12 Medeiros MA et al. A reassessment of the role of serotoninergic system in the control of feeding behavior. An Acad Bras Cient 2005 ; 77 : 103-11.
13 Nieuwenhuizen AG et al. Acute effects of breakfasts containing alpha-lactalbumin, or gelatin with or without added tryptophan, on hunger, 'satiety' hormones and amino acid profiles. Br J Nutr 2009 ; 101 : 1859-66.
14 Pagoto SL et al. Acute tryptophan depletion and sweet food consumption by overweight adults. Eat Behav 2009; 10 : 36-41.
15 Smith KA et al. Symptomatic relapse in bulimia nervosa following acute tryptophan depletion. Arch Gen Psychiatry 1999 ; 56 : 171-6.
16 Veldhorst MA et al. A breakfast with alpha-lactalbumin, gelatin, or gelatin+TRP lowers energy intake at lunch compared with a breakfast with casein, soy, whey, or whey-GMP. Clin Nutr. 2009; 28 : 147-55
17 Voracek M. Dietary tryptophan intake and suicide rate in industrialized nations. J Affect Disord 2007 ; 98 : 259-62.
Publié en 2011
