Évolution de l'IMC entre 2 et 10 ans : facteur de risque à l'adolescence ?
M. Rémi NEVEU – Ingénieur de Recherche, Lyon
Résultats préliminaires d'une étude cas-témoins.
R. Neveu1, D. Neveu2, E. Carrier3, A. Perroud4
1 Institut des Sciences Cognitives, CNRS, Bron ; 2 Université Montpellier 1, CHU, Départemennt de l'information médicale, Montpellier ; 3 Clinique Saint Vincent de Paul, Lyon ; 4 Clinique des Vallées, Ville-la-Grand
L’indice de masse corporelle (IMC) est une donnée centrale dans le diagnostic de l’anorexie mentale et dans sa prise en charge. Cependant, on observe une faible corrélation entre l’IMC des sujets au début de leur prise en charge et l’IMC mesuré plusieurs années après (0,24 à 0,34 ; Hebebrand & al, 1996 ; Hebebrand & al, 1997 ; Pinter & al, 2004). Mais ces études de cohorte n’ont pris en compte ni les valeurs, ni l’évolution de l’IMC des sujets avant l’apparition de l’anorexie.
Des études chez les jumeaux homozygotes et hétérozygotes suggèrent d’une part que l’apparition du trouble est due principalement aux facteurs génétiques (64% à 74%) et secondairement aux évènements de vie propres, événements non communs aux membres d’une famille vivant sous un même toit (26% à 36% ; Rutherford & al, 1993 ; Klump & al, 2001 ; Klump & al, 2002 ; Reichborn-Kjennerud & al, 2004). D’autre part, chez des jumeaux sains, 67 à 80% de la variabilité dans l’évolution de l’IMC serait due à des facteurs génétiques, le restant étant expliqué par les évènements de vie propres à la personne (Maes & al, 1997 ; Faith & al, 2006). D’une part les mêmes facteurs expliquent la survenue de l’anorexie et les variations dans l’évolution de l’IMC chez les sujets sains. D’autre part ces facteurs interviennent dans des proportions quasiment identiques. Des facteurs pourraient donc être communs à l’apparition du trouble et aux fluctuations de l’IMC au cours du temps.
Plusieurs gènes contribueraient seuls ou en association au déclenchement du trouble et à sa gravité (Klump & al, 2005 ; Ricca & al, 2004 ; Brown & al, 2006 ; Urwin & al, 2005). Parmi ceux intervenant dans le déclenchement du trouble figurent les gènes codant pour le BDNF, les récepteurs cannabinoïdes (CNR1), les neuropeptides Y et AGRP ((Ribasés & al, 2003 & 2005 ; Siegfried & al, 2004 ; Dardennes & al, 2007). De plus, le facteur neurotrophique BDNF, l’hormone ghrelin, les neuropeptides, Y antagoniste de la leptine et AGRP et les récepteurs endocannabinoïdes interviennent dans la régulation du poids et la prise alimentaire (Xu & al, 2003 ; Morton & al, 2006 ; Nakazato & al, 2001 ; Dardennes & al, 2007 ; Batterham & al, 2002 ; Stephens & al, 1995 ; Di Marzo & al, 2001 & 2005). Ces mêmes facteurs influent sur les comportements alimentaires pouvant aboutir à l’anorexie (Zigman & al, 2003). Il est donc possible qu’ils modulent l’évolution du poids avant l’apparition du trouble.
Notre étude cas-témoins a cherché à déterminer s’il existait une association entre l’évolution de l’IMC mesuré avant l’apparition du trouble entre 2 et 10 ans et la survenue du trouble après 10 ans et avant 25 ans.
1. Sujets et méthodes
Cette étude est une enquête observationnelle rétrospective de type cas-témoins effectuée en France dans la région Rhône-Alpes de juin 2003 à juin 2007, auprès de 2 cliniques spécialisées ainsi que d’une école d’ingénieurs, de 3 universités, 3 lycées, 3 écoles d’infirmières et d’un centre de recherche.
Les cas relevés ont été des sujets hommes et femmes de plus de 10 ans et de moins de 35 ans pour lesquels le diagnostic d’anorexie selon les critères du DSM IV doit avoir été posé avant 25 ans. Les sujets ne doivent pas présenter après 25 ans de première évolution de leur courbe IMC en dessous du critère diagnostique de l’anorexie portant sur l’IMC, corrigé par rapport au sexe et à la déviation temporelle (Hebebrand & al, 1996). Les sujets anorexiques ne doivent pas présenter de surpoids dans l’historique de leur IMC, surpoids défini selon l’IMC corrigé en fonction de l’âge (Kopelman PG, 2000) ou par le 85ème percentile (Must A. & al, 1991). Les points d’IMC relevés doivent satisfaire une période d’échantillonnage de 3,96 ans (période déterminée par analyse des données d’IMC de référence de la population française (Rolland-Cachera & al, 1991) par transformée de Fourrier et interpolations polynomiales) et être au nombre de 4 au minimum sur la période 2-10 ans. Les sujets expérimentaux ne doivent pas avoir connu de phase boulimique ni présenter ou avoir présenté de dépendance à une substance psychotrope ayant un effet avéré sur l’évolution du poids avant le premier diagnostic d’anorexie. Ils ne doivent avoir aucun lien de parenté au premier degré avec un autre sujet de l’étude.
Les sujets contrôles appariés aux cas sur le sexe, doivent avoir entre 10 et 35 ans et ne doivent présenter ni de diagnostic de trouble alimentaire, ni d’obésité ou de surpoids mentionné dans le carnet de santé ou dans l’historique de leur IMC. Ils ne doivent pas avoir de frère ou de sœur atteint d’un trouble alimentaire et aucun lien de parenté au premier degré avec un autre sujet de l’étude.
La date de naissance, le sexe, le mode de financement, le lieu de vie, la situation familiale, le niveau scolaire atteint, la profession des parents, les noms et prénoms des parents constituant les données socio-démographiques ont été relevés à l’aide d’un auto-questionnaire.
L’IMC des sujets a été relevé à partir des données de poids et de taille consignées au cours du temps dans le carnet de santé. 41,3% des sujets expérimentaux et 16% des témoins proviennent des archives de mai 2003 à juin 2006 d’une des deux cliniques. Les données de poids et de taille avaient dans ce cas été interpolées linéairement à la date d’anniversaire la plus proche quand elles ne correspondaient pas exactement avec cette dernière. Le reste des sujets a été recruté entre septembre 2006 et juin 2007 : les données exactes (poids, taille, maladie éventuelle signalée lorsque le médecin a rempli le carnet de santé et date à laquelle ce dernier a été complété) ont été relevées.
Le critère de jugement principal est l’IMC calculé par le rapport du poids en kg par le carré de la taille en mètres.
95 cas et 95 témoins devaient être recrutés pour détecter une différence moyenne d’IMC de 0,99 avec une puissance statistique de 80% et un risque a de 0,05, le test étant bilatéral. L’écart-type de l’IMC était celui de la population française de référence (Rolland-Cachera & all, 1991).
2. Analyses statistiques
Les caractéristiques socio-démographiques des deux groupes ont été comparées à l’aide d’un test ![]() les variables qualitatives et avec un test de Student pour les variables quantitatives dans le cas où leur distribution est gaussienne sinon avec un test de Mann-Whitney-Wilcoxon.
les variables qualitatives et avec un test de Student pour les variables quantitatives dans le cas où leur distribution est gaussienne sinon avec un test de Mann-Whitney-Wilcoxon.
L’analyse des données d’IMC répétées, déséquilibrées et incomplètes a fait appel à un modèle mixte (procédure MIXED de SAS 9.1 et fonction aoctool de la toolbox de statistique de matlab 7.2). Une comparaison intra groupe par modèle mixte entre les deux périodes 2-5 ans et 6-10 ans a été effectuée pour chacun des groupes après avoir multiplié par -1 l’intégralité des données entre 6 et 10 ans.
Pour chaque sujet ont été estimés l’intégrale de la droite de régression calculée entre 2 et 5 ans et le rapport des pentes de cette droite de régression à celle calculée entre 6 et 10 ans inclus. Une régression linéaire a ensuite été effectuée entre l’intégrale et ce rapport de pentes.
Le nombre de données manquantes dans les deux groupes a été comparé à l’aide d’un test de Mann-Whitney-Wilcoxon. Pour chaque groupe, la distribution des rapports entre les nombres de points d’IMC avant 5 ans inclus et après 6 ans inclus a été étudiée à l’aide de l’algorithme SAEM pour examiner un éventuel déséquilibre entre les deux groupes dans les contributions aux estimations des paramètres des modèles mixtes.
Le point de rebond de chaque sujet a été estimé par le point où s’annule la dérivée du polynôme de régression des points d’IMC. Ces points de rebond ont été comparés entre les deux groupes à l’aide d’un test de Mann-Whitney-Wilcoxon.
La robustesse des résultats portant sur l’IMC a été étudiée avec 1000 jeux de données où à chaque point d’IMC, une quantité aléatoire variant entre -2,6% et 2,6% de sa valeur a été ajoutée. Le nombre de fois où le résultat du test effectué était contraire à celui obtenu initialement a été relevé. Le seuil de signification était de 0,05.
3. Résultats
Les données de 109 sujets malades (107 femmes et 2 hommes) et 75 sujets sains (75 femmes) ont pu être exploitées sur 139 sujets anorexiques et 87 sujets sains relevés. Les résultas présentés ne sont de ce fait que des résultats préliminaires en attendant que les deux groupes soient appariés en nombre.
Les sujets des deux groupes étaient comparables pour les données socio démographiques (tableau 1) ainsi que pour le nombre de données manquantes. Les rapports entre le nombre de données d’IMC avant 5 ans et après 6 ans ne forment qu’un groupe pour les sujets sains alors que pour les sujets anorexiques, il existe 4 groupes dont un prédominant comparable à celui des sujets sains.
Tableau 1: caractéristiques des deux groupes
| Patients (N=109) |
Healthy subjects (N=75) |
|
| Age, year mean (SD) | 20.76 (4.37) | 21.24 (4,56) |
| Brothers, number mean (SD) | 0.846 (0.854) | 0.675 (0.727) |
| Sisters, number mean (SD) | 0.68 (0.814) | 0.882 (0.978) |
| years of study after high school mean (SD) | 0.936 (2.315) | 1.235 (2.217) |
| Divorce N (%) | (0.244) | (0.294) |
On observe une différence significative d'IMC à 2 ans entre les cas et les témoins (groupe témoin : 15.1962 et cas : 15,756, p<0.0018). Cette différence se maintient au cours du temps jusqu’au point de rebond sans observer de différence significative sur la concavité des courbes entre 2 et 10 ans (p = 0,11). Sur chacune des périodes 2-5 ans et 6-10 ans, les pentes de l’IMC n'étaient pas significativement différentes entre les sujets sains et les sujets anorexiques. En revanche, les pentes sont comparables en valeur absolue avant et après points de rebond chez les sujets anorexiques alors que chez les sujets sains, on observe une tendance à une différence significative (p=0,07).
Figure 1 : BMI evolution of patients (blue) and healthy subjects (red)
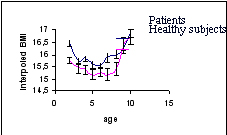
Les points de rebond estimés à partir des données interpolées sont comparables en moyenne entre les deux groupes (p=0,54). Parmi les 1000 jeux de données engendrés dans l'analyse de robustesse de ce résultat, 6 présentent un degré de signification inférieur à 5%.
4. Discussion
Dans cette étude cas-témoins, on observe une différence d’évolution de l’IMC entre 2 et 10 ans entre les sujets malades et les sujets sains. Cette période précède l'apparition du trouble. Les sujets malades auraient tendance à avoir un IMC supérieur à celui des sujets sains avant le point de rebond avec une différence se maintenant sur toute la période 2-5 ans. L'évolution de l'IMC chez les cas est globalement symétrique par rapport à leur point de rebond alors que chez les sujets sains, elle est plus rapide après le point de rebond.
L’âge de rebond d’adiposité n’est pas différent chez les sujets anorexiques que chez les sujets sains contrairement à ce qu'on observe dans l'obésité (Rolland-Cachera & al, 2006).
Un des points forts de cette étude réside dans le mode de recueil du poids et de la taille, notés par des médecins généralistes dans le carnet de santé des sujets. En effet, une sous-estimation de l'IMC a été mise en évidence lorsque les sujets relèvent eux-mêmes leur poids et leur taille (Rowland, 1990). Ces données sont donc fiables dans la limite des fluctuations liées aux instruments de mesure et au moment où est effectué le relevé. Ces variations ont été estimées au plus à 5,2% de l’IMC relevé. L'analyse de robustesse suggère que les résultats étaient robustes par rapport à ces sources de fluctuation.
Le choix de n’inclure que des sujets avec un nombre suffisant de points d'IMC pour reconstruire la courbe d'IMC permet d'estimer correctement d'un côté l'association entre l'évolution de l'IMC entre 2 et 10 ans et le statut du sujet et d'un autre côté de comparer les évolutions de l'IMC de part et d'autre du point de rebond.
Les limites de cette étude résident dans les critères de sélection des cas et des témoins. Les cas, recrutés lors de leur entrée en hospitalisation dans des cliniques spécialisées présentent vraisemblablement un trouble plus important que l'ensemble des anorexiques. Le résultat de cette étude ne peut donc pas être étendu à l’ensemble de la population des personnes souffrant d’anorexie. D’autre part, le faible nombre de sujets satisfaisant tous les critères d'inclusion sauf celui d'échantillonnage de l'IMC ne permet pas de comparer ces sujets exclus aux sujets inclus dans le but de rechercher s'ils sont comparables quant à leurs caractéristiques socio-démographiques.
Les sujets témoins sont considérés comme sains lors de leur inclusion. Mais certains pourraient développer une anorexie par la suite. Dans le cas où les témoins seraient représentatifs de la population générale, la proportion de ceux développant ultérieurement une anorexie serait alors au plus similaire à la prévalence de l’anorexie dans la population générale soit 0,3% à 1% (De Filippo & al, 2000 ; Kaye & al, 2000). Le biais éventuel de sélection serait de ce fait négligeable. Cependant les sujets sains sont recrutés sur la base du volontariat. Wagner & al ont observé que les anorexiques guéris ont pour trait de personnalité d’être plus coopératifs que les sujets sains (Wagner & al, 2006). On pourrait suspecter un biais de sélection supplémentaire dans notre étude si la coopération est un facteur de risque d'anorexie. Or les facteurs de risque d’apparition de l’anorexie chez les personnes saines sont avant tout une personnalité perfectionniste et une mauvaise estime de soi (Fairburun & al, 1999) et Wagner & al n'étudiaient pas si la coopération était un facteur de risque d'apparition de l'anorexie.
En raison de ces limites inhérentes à une étude cas-témoins, une étude de cohorte prospective serait nécessaire pour confirmer ces résultats et pour tenir compte de facteurs tels que le génotype et les concentrations sanguines des différents neuropeptides et hormones dont les gènes sont impliqués dans l’apparition de la maladie.
En conclusion, cette étude suggère que chez les futurs anorexiques, l'IMC aurait tendance à être constamment au dessus de la moyenne avant le point de rebond et que son évolution serait plus lente que chez les sujets sains après le point de rebond. Après confirmation, ces résultats suggèreraient qu’un dépistage simple basé sur l'évolution de l'IMC avant 10 ans serait possible par des médecins généralistes.
5. Bibliographie
1. Batterham RL, Cowley MA, Small CJ, Herzog H, Cohen MA, Dakin CL, Wren AM, Brynes AE, Low MJ, Ghatei MA, Cone RD, Bloom SR, « Gut hormone PYY3-36 physiologically inhibits food intake », Nature, 2002, vol. 418, pp. 650-654.
2. Brown KMO, Bujac SR, Mann ET, Campbell DA, Stubbins MJ, Blundell JE, « Further evidence of association of OPRD1&HTR1D polymorphisms with susceptibility to anorexia nervosa », Biology psychiatry, 2006, in press.
3. Dardennes RM, Zizzari P, Tolle V, Foulon C, Kipman A, Romo L, Iancu-Gontard D, Boni C, Sinet PM, Bluet MT, Estour B, Mouren MC, Guelfi JD, Rouillon F, Gorwood P, Epelbaum J, « Family trios analysis of common polymorphisms in the obestatin/ghrelin, BDNF and AGRP genes in patient with anorexia nervosa: association with subtype, body-mass index, severity and age of onset », Psychoneuroendocrinology, 2007, article in press.
4. De Filippo E, Signorini A, Bracale R, Pasanisi F, Contaldo F, « Hospital admission and mortality rate in anorexia nervosa : experience from an integrated medical-psychiatric outpatient treatment », Eating & Weight disorders, 2000, vol. 5, pp. 211-216.
5. Di Marzo V, Matias I, « Endocannabinoid control of food intake and energy balance », Nature neuroscience, 2005, vol. 8, pp. 585-589.
6. Di Marzo V, Goparaju SK, Wang L, Liu J, Batkai S, Jarai Z, Fezza F, Miura GI, Palmiter RD, Sugiura T, Kunos G, « Leptin-regulated endocannabinoids are involved in maintaining food intake », Nature, 2001, vol. 410, pp. 822-825.
7. Fairburn CG, Cooper Z, Doll HA, Welch SL, « Risk factors for anorexia nervosa : three integrated case-control comparisons », Archives of general psychiatry, 1999, vol. 56, pp. 468-476.
8. Faith MS, Pietrobelli A, Nuñez C, Heo M, Heymsfield SB, Allison DB, « Evidence for independent genteic influences on fat mass and body mass index in a pediatric twin sample », Pediatrics, 1999, vol.104, pp. 61-67.
9. Hebebrand J, Himmelmann GW, Heseker H, Schäfer H, Remschmidt H, « Use of percentiles for the body mass index in anorexia nervosa : diagnostic, epidemiological, and therapeutic considerations », International journal of eating disorders, 1996, vol. 19, pp. 359-369.
10. Hebebrand J, Himmelmann GW, Wewetzer C, Gutenbrunner C, Heseker H, Schäfer H, Remschmidt H, « Body weight in acute anorexia nervosa anda t follow up assessed with percentiles for the body mass index : implications of a low body weight at referral », International journal of eating disorders, 1996, vol. 19, pp. 347-357.
11. Hebebrand J, Himmelmann JW, Herzog W, Herpertz-Dahlmann BM, Steinhausen HC, Amstein M, Seidel R, Deter HC, Remschmidt H, Schäfer H, « Prediction of low body weight at long-term follow-up in acute anorexia nervosa by low body weight at referral », American journal of psychiatry, 1997, vol. 154, pp. 566-569.
12. Kaye WH, Klump KL, Frank GKW, Strober M, « Anorexia and bulimia nervosa », Annual review of medicine, 2000, vol. 51, pp. 299-313.
13. Klump KL, Gobrogge KL, « A review and primer of molecular genetic studies of anorexia nervosa », International journal of eating disorders, 2005, vol. 37, pp. S43-S48.
14. Klump KL, Miller KB, Keel PK, McGue M, Iacono WG, « Genetic and environmental influences on anorexia nevrosa syndromes in a population-based twin sample », Psychology medicine, 2001, vol. 31, pp. 737-740.
15. Klump KL, Wonderlich S, Lehoux P, Lilenfeld LRR, Bulik CM, « Does environment matter ? A review of non shared environment and eating disorders », International journal of eating disorders, 2002, vol. 31, pp. 118-135.
16. Kopelman PG, « Obesity as a medical problem », Nature, 2000, vol. 404, pp. 635-643.
17. Maes H, Neale MC, Eaves LJ, « Genetic and environmental factors in relative body weight and human adiposity », Behavior genetics, 1997, vol. 27, pp. 325-351.
18. Morton GJ, Cummings DE, Baskin DG, Barsh GS, Schwartz MW, « Central nervous system control of food intake and body weight », Nature, 2006, vol. 443, pp. 289-295.
19. Must A, Dallal GE, Dietz WH, « Reference data for obesity: 85th and 95th percentiles of body mass index (wt/ht2) and triceps skinfold thickness », The American Journal of Clinical Nutrition, 1991, vol. 53, pp. 839-846.
20. Nakazato M, Murakami N, DateY, Kojima M, Matsuo H, Kangawa K, Matsukura S, « A role of ghrelin in the central regulation of feeding », Nature, 2001, vol. 409, pp. 194-198.
21. Pintér O, Probst M, Vandereycken W, Pieters G, Goris M, « The predictive value of body mass index for the weight evolution in anorexia nervosa », Eating & Weight disorders, 2004, vol. 9, pp. 232-235.
22. Reichborn-Kjennerud T, Bulik CM, Kendler KS, Roysamb E, Tambs K, Torgersen S, Harris JR, « Undue influence of weight on self-evaluation : a population based twin study of gender differences », International journal of eating disorders, 2004, vol. 35, pp. 123-132.
23. Ribasés M, Gratacos M, Armengol L, de Cid R, Badia A, Jiménez L, Solano R, Vallejo J, Fernandez F, Estivill X, « Met66 in the brain-derived neurotrophic factor (BDNF) precursor is associated qith anorexia nervosa restrictive type », Molecular psychiatry, 2003, vol. 8, pp. 745-751.
24. Ribasés M, Gratacos M, Badia A, Jiménez L, Solano R, Vallejo J, Fernandez-Aranda F, Estivill X, « Contribution of NTRK2 to the genetic susceptibility to anorexia nervosa, harm avoidance and minimum body-mass index », Molecular psychiatry, 2005, vol. 10, pp. 851-860.
25. Ricca V, Nacmias B, Boldrini M, Cellini E, di Bernardo M, Ravaldi C, Tedde A, Bagnoli S, Placidi GF, Rotella CM, Sorbi S, « Psychopathological traits and 5-HT2A receptor promoter polymorphism (-1438G/A)in patients suffering from anorexia nervosa and bulimia nervosa », Neuroscience letters, 2004, vol. 365, pp. 92-96.
26. Rolland-Cachera MF, Cole TJ, Sempé M, Tichet J, Rossignol C, Charraud A, « Body mass index variations : centiles from birth to 87 years », European journal of clinical nutrition, 1991, vol. 45, pp. 13-21.
27. Rolland-Cachera MF, Deheeger M, Maillot M, Bellisle F, « Early adiposity rebound : causes and consequences for obesity in chidren and adults », International journal of obesity (London), 2006, vol. 30, pp. 11-17.
28. Rowland ML, « self-reported weight and height », The American Journal of Clinical Nutrition, 1990, vol. 52, pp. 1125-1133.
29. Rutherford J, McGuffin P, Katz RJ, Murray RM, « Genetic influences on eating attitudes in a normal female twin population », Psychology medicine, 1993, vol. 23, pp. 425-436.
30. Siegfried Z, Kanyas K, Latzer Y, Karni O, Bloch M, Lerer B, Berry EM, « Associated study of cannainoid receptor gene (CNR1) alleles and anorexia nervosa : differences between restrictive and bingeing/purging subtypes », American Journal of medical genetics part B (Neuropsychiatric genetics), 2004, vol. 125 B, pp. 126-130.
31. Stephens TW, Basinski M, Bristow PK, Bue-Valleskey JM, Burgett SG, Craft L, Hale J, Hoffmann J, Hsiung HM, Kriauciunas A, MaxKellar W, Rostaeck PRJr, Schoner B, Smith D, Tinsley FC, Zhang XY, Heiman M, «The role of neuropeptide Y in the antiobesity action of the obese gene product », Nature, 1995, vol. 377, pp. 530-532.
32. Urwin RE, Nunn KP, « Epistatic interaction between the monoamine oxydase A and serotonin transporter genes in anorexia nervosa », European journal of human genetics, 2005, vol. 13, pp. 370-375.
33. Wagner A, Barbarich-Marsteller NC, Frank GK, Bailer UF, Wonderlich SA, Crosby RD, Henry SE, Vogel V, Plotnicov K, McConaha C, Kaye WH, « Personality traits after recovery from eating disorders : do subtypes differ ? », International journal of eating disorders, 2006, vol. 39, pp. 276-284.
34. Xu B, Goulding EH, Zang K, Cepoi D, Cone RD, Jones KR, Tecott LH, Reichardt LF, « Brain-derived neurotrophic factor regulates energy balance downstream of melanocortin-4 receptor », Nature neuroscience, 2003, vol.6, pp. 736-742.
35. Zigman JM, Elmquist JK, « Minireview : from anorexia to obesity – the yin and yang of body weight control », Endocrinology, 2003, vol. 144, pp. 3749-3756.
Publié en 2010
