Chirurgie de l'obésité
1. Introduction
L’obésité touche actuellement en France à peu près 10 % des adultes et des enfants. Les échecs de la prise en charge médicale restent fréquents : 60 à 80 % des malades ont repris une grande partie du poids perdu après 5 ans de suivi. Ceci fait le « succès » de la chirurgie de l’obésité. L’émergence de la chirurgie sous laparoscopie et le souhait des malades d’un traitement sans contrainte expliquent le regain de demande d’intervention. Mais qu’en est-il exactement ?
2. Obésité : définitions et réflexions
L’obésité se définit comme un état où l’excès de masse grasse (et de tissu adipeux) est associé à un surcroît de morbidité et de mortalité. On parle d’obésité morbide lorsque la surcharge pondérale est compliquée d’une affection liée à l’obésité (hypertension artérielle, diabète, insuffisance coronarienne… voir Tableau I). On distingue aussi, en fonction de l’incidence des complications associées, l’obésité androïde, où l’essentiel de la masse grasse s’est déposé au sein du tissu abdomino-mésentérique et tronculaire et l’obésité gynoïde où l’excès de masse est localisé à la partie basse du corps (fesse, cuisses).
Pour que se développe un surpoids, il faut que les apports caloriques (glucides et lipides) soient durablement supérieurs aux dépenses. Tant que le bilan « entrées – sorties » d’énergie est positif, on prend du poids. S’il est nul, le poids est stable. S’il est négatif, le poids diminue. Mais les dépenses énergétiques s’adaptent aux apports. Lorsqu’un malade obèse restreint ses apports, sa dépense énergétique diminue (d’environ 10 %), annulant une partie des efforts consentis. Par ailleurs, certains obèses ont une dépense énergétique de repos faible. Donc leur poids est stable pour des apports énergétiques qui feraient maigrir un sujet mince.
En d’autres termes :
- Les objectifs pondéraux doivent être réalistes et s’inscrire dans la durée !
- Le traitement de l’obésité ne consiste donc pas à réduire sans conscience les apports énergétiques (caloriques), sans s’occuper des conséquences à très long terme de la restriction alimentaire et des déficits en minéraux et vitamines qu’elle peut occasionner.
3. Les différents types d'interventions chirurgicales gastriques
Trois types d’interventions gastriques sont pratiqués :
- les gastroplasties
- les anneaux gastriques ajustables
- les by-pass gastriques ou courts-circuits gastriques.
On peut les pratiquer « à ventre ouvert » ou sous laparoscopie (appelée aussi coelioscopie), c’est-à-dire à l’aide d’instruments longs introduits par une « boutonnière » abdominale, le ventre ayant été préalablement gonflé.
Les gastroplasties et les anneaux gastriques ajustables isolent du reste de l’estomac une « poche » haut située (sous le cardia, la porte d’entrée de l’estomac). Cette poche fait 60 mL environ (un demi verre, un demi pot de yaourt). L’écoulement se fait par un chenal de 7 à 8 mm (la largeur d’un crayon). La poche (le « néogastre ») est presque dépourvue de fibres musculaires, donc elle peut se distendre.
Les gastroplasties isolent le néogastre grâce à une double rangée d’agrafes posées verticalement. En cas de laparotomie, les 2 parties de l’estomac sont solidaires, alors qu’en cas de chirurgie sous laparoscopie, une section est effectuée entre les 2 parties de l’estomac.
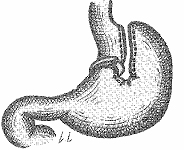 |
La gastroplastie verticale bandée sous coelioscopie (laparoscopie) consiste à couper l’estomac dans la longueur et à empêcher qu’il ne se dilate par une bande placée autour de la petite courbure. |
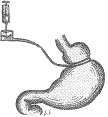 |
Le chirurgien passe un anneau gonflable autour de l’estomac. L’anneau est relié à un cathéter (tuyau) qui se termine par une petite poche que l’on peut gonfler avec de l’eau pour « resserrer » un peu l’anneau si le patient peut manger « trop », ou le desserrer s’il vomit trop. |
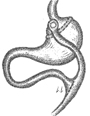 |
Le chirurgien ferme l’estomac par deux rangées d’agrafes ; les aliments passeront alors par le bout d’intestin monté. |
4. Les mécanismes de la perte de poids
La cavité d’accueil des aliments est réduite artificiellement à la moitié d’un verre d’eau (60 mL, ou 30 g de pain, ou un demi yaourt). Or, au cours du repas, c’est le volume et la pression qu’elle génère qui limitent le mieux la prise alimentaire. L’estomac parait plein.
Rappelons que normalement, la capacité de l’estomac est supérieure au litre.
La chirurgie bariatrique fait perdre du poids pour deux raisons :
1. Elle réduit à rien la contenance gastrique et donc la tolérance à l’ingestion ;
2. Elle crée, du fait de la douleur et des vomissements qu’elle induit, un réflexe conditionné de peur et de rejet des repas.
Après chirurgie bariatrique gastrique, il n’est plus question de repas de volume normal (600 à 800 mL, hors boissons). Le malade va rejeter tout aliment volumineux.
5. La chirurgie laparoscopique
C’est l’avènement de la chirurgie laparoscopique qui a fait « exploser » la chirurgie bariatrique. En effet, après laparotomie qui fait courir au patient obèse un risque post-opératoire 2 à 4 fois supérieur à celui encouru par le sujet de poids normal : lâchage de sutures, infections, thrombo-phlébite et embolie pulmonaire. Il faut donc que le sujet obèse opéré reste alité le moins longtemps possible et soit mis sous traitement iso- ou hypocoagulant au cours de la période post-opératoire.
La chirurgie bariatrique gastrique sous laparoscopie donne de meilleures suites opératoires, avec un taux moindre de complications immédiates que celle sous laparotomie. Mais elle nécessite des instruments adaptés à l’obèse (de plus grande longueur). La conversion en laparotomie est rarement nécessaire : de 2 à 6 % des cas en moyenne.
6. Temps opératoire, durée de séjour, morbidité et mortalité
Le temps opératoire est actuellement de 60 à 80 min entre des mains entraînées.
La durée d’hospitalisation après laparoscopie est de 2 jours avec des extrêmes de 1 à 8 jours. Au total, durée d’intervention, lever du malade (1 à 2 jours), reprise de l’alimentation (2 à 4 jours) et durée de séjour sont plus courts après laparoscopie qu’après laparotomie. La durée de confection d’un court-circuit gastrique est de 70-90 min.
Morbidité : L’ensemble des complications post-opératoires « notables » est de 2 à 8 % (11,12,15) :
- migration de l’anneau : 1 à 4 % des cas
- infection du site implantable : dans 1-2 % des cas
- lâchage de suture précoce observé dans 0,4 à 6 % des gastroplasties
- ulcérations gastriques sévères menant à une ré-intervention : 0,6 % des cas
- perforations gastriques avec péritonite : 0 à 3 % des cas
- hémorragie gastrique (< 1 %)
- dilatation de l’œsophage : 0,5 %
- reflux gastro-oesophagien : 2 à 6 %. On ignore la fréquence réelle de l’œsophagite.
- Surtout, vomissements : 30 à 75 % des malades continuent à vomir au moins une fois par semaine 12 mois après l’opération.
Insuffisances techniques : Un glissement de l’estomac au travers de l’anneau, qui induit l’agrandissement de la poche, est observé dans 1 à 6 % des cas. Pour l’éviter, on peut fixer l’œsophage et la partie haute de l’estomac. Une dilatation excessive de la poche, obligeant à une ré-intervention dans un cas sur 2, est observée dans 2 à 10 % des cas. Après court-circuit gastrique (Roux-en-Y bypass), 3 à 6 % des malades doivent être réopérés pour dilatation de la poche gastrique ou de l’anse.
Mortalité : Elle est minime : en totalisant environ 2000 malades, 6 études n’ont enregistré aucun décès (2, 11, 12, 14, 15, 22). Dans une autre série de gastroplastie et de court-circuit gastrique, la mortalité a été de 1,1 % (23, 24) ; dans une série de pose d’anneaux gastriques la mortalité était de 1,4 % (10). La mortalité après court-circuit gastrique est faible également : 0 % sur 508 malades (17, 25).
Ré intervention : Selon les études, le pourcentage de ré intervention en cas d’anneau ou de gastroplastie varie de 5 à 8 %. Dans leur série de court-circuit gastrique sous coelioscopie, Higa et al rapportent une conversion en laparotomie chez 3 % de leurs 400 malades et une ré intervention chez 0,4 % d’entre eux.
7. Les résultats à 5 ans
Ce sont majoritairement des femmes qui sont opérées (dans 60 à 80 % des cas), et ce alors que les affections associées à l’obésité sont beaucoup plus fréquentes chez l’homme.
7.1. Perte de poids et composition corporelle
La perte de poids à 2-3 ans est importante (Tableau II, Figure 1) : de 20 à 30 kg, à comparer aux 0 à 15 kg du traitement médical et diététique.
Les résultats sur la composition corporelle sont également impressionnants (Figure 2). La perte de poids à 2-3 ans est liée pour 60 à 75 % à une perte de masse grasse. Mais dans les 4 premières semaines, l’essentiel de la perte de poids est de l’eau : de 3 à 6 kg selon la rapidité du déficit. Ceci est en partie lié à l’excès d’eau qui accompagne toute obésité (de 4 à 8 kg). Il y a également une perte de masse maigre (et musculaire) inéluctable. Les raisons en sont connues : les apports alimentaires en NaCl et en protéines sont fortement réduits, toute perte de poids s’accompagne d’une certaine perte de masse musculaire.
7.2. Complications associées
La chirurgie gastrique de l’obésité s’accompagne d’une forte réduction du nombre et de la fréquence (Figure 3), tout comme de l’intensité des complications associées : diminution marquée de la pression artérielle au repos et à l’effort et des difficultés respiratoires, mais aussi de la résistance à l’insuline, des triglycérides plasmatiques et de l’uricémie et augmentation du HDL-cholestérol. Chez les diabétiques de type 2 (non insulino-dépendant), on observe une baisse notable de la glycémie, de l’Hb A1c et des triglycérides.
7.3. Prise alimentaire
La plupart des patients ont des difficultés à ingérer de la viande, du poisson, des crudités, des légumes et des fruits et à un moindre degré des fromages à pâte dure. Beaucoup calment leur faim à l’aide de produits liquides sucrés-gras (crèmes glacées, crèmes desserts, sodas) et 71 % des malades disent encore vomir plusieurs fois par semaine un à trois ans après l’intervention.
Dans l’ensemble, les résultats nutritionnels de la chirurgie gastrique de l’obésité ne sont donc pas satisfaisants. En effet, nombre de malades adoptent une alimentation assez ou très pauvre en protéines, du fait de la réduction de la consommation de viandes et de poissons (qui ne passent pas). Beaucoup réduisent leurs apports en vitamines anti-oxydantes (anti-vieillissement) : vitamine A et rétinoïdes, C, E et caroténoïdes, réduisent à rien leurs apports en fibres, solubles et a fortiori insolubles, et en eau, du fait de l’exclusion des fruits et légumes, notamment crus.. Les malades, assez souvent, boivent peu. Leur tendance spontanée devient celle de couvrir leurs besoins énergétiques par des produits manufacturés prêts à l’emploi et denses en énergie (sucré-gras, type barres chocolatées).
La poche néoformée se dilate souvent au fil du temps. C’est ce qui fait que les malades mangent plus, 3 ans plus tard, qu’au début. Les vomissements, constants au début, tendent à s’atténuer. Mais ils ne disparaissent pas tout à fait dans plus de deux tiers des cas.
Les conséquences sur le comportement alimentaire et l’émergence de troubles du comportement alimentaire paraissent importantes. Un tiers des malades auraient un trouble du comportement alimentaire. Il s’agit surtout de compulsions alimentaires et de tendances à soulager l’angoisse par l’alimentation (plus d’un quart des malades). La peur de manger, des pensées dichotomiques rigides apparaissent dans un certain nombre de cas (un malade sur sept à dix ?). Les patients qui avaient une nette tendance aux troubles du comportement alimentaires avant l’opération la gardent ou la renforcent ensuite, surtout s’il s’y associe des traits anxieux ou un état dépressif. Les compulsions nocturnes touchent 27 % des patients après chirurgie gastrique de l’obésité.
En fait, il est évident que le comportement alimentaire ne peut être que très perturbé : temps du « repas » insuffisant, structure du « repas » éclatée, diversité alimentaire réduite, sensations autour du repas (faim, rassasiement) très modifiée. Le trouble le plus fréquent est la compulsion alimentaire liquide ou semi-liquide sévère, faite de sodas, crèmes glacées, yaourts liquides… Elle est le mécanisme principal de l’échec à long terme de la chirurgie gastrique de l’obésité. Elle touche peut-être 6 à 8 % des malades.
8. Les résultats à long terme
L’évolution du poids, au delà des 5 premières années, est moins satisfaisante : un malade sur six ou sept (15 %) reprend une partie ou la totalité du poids perdu.
Certes, ce sont de meilleurs résultats que ceux du sous traitement médical, mais qu’en sera-t-il 5 ans plus tard (à 10 ans) ?
L’évolution, à 10 ans ou plus, de la composition corporelle, du comportement alimentaire et des complications associées n’est pas connue.
Y aura-t-il à long terme une altération de l’estomac ? Qu’en sera-il de l’état de la muqueuse gastrique : gastrite, infection par Hélicobacter pylori ?
Le risque de mortalité à long terme est inconnu. Il est probable qu’il n’est pas nul. En effet, un certain nombre de malades sont ou seront dénutris du fait de la chirurgie bariatrique. Or, cette dénutrition, qui peut intéresser tout autant le secteur protéique et musculaire que certaines fonctions en rapport avec des carences vitaminiques ou minérales, sera difficile à mettre en évidence. Il s’agit en effet d’une dénutrition par carence d’apport liée à la forte restriction alimentaire en aliments protéiques et riches en minéraux ou vitamines (magnésium, fer, folates, zinc, vitamines A et E en particulier). Et l’on sait que ce type de dénutrition est, dans d’autres circonstances, responsable d’environ 10 % de décès à long terme (10 ans ou plus) sans que les marqueurs usuels de la dénutrition (albuminémie, pré-albuminémie, hémoglobine, calcémie...) ne la diagnostique facilement.
8.1. Les lésions endoscopiques
Il n’y a pas eu d’études endoscopiques systématiques permettant de préciser la fréquence des lésions oesogastriques. L’oesophagite de reflux est connue. Les lésions gastriques le sont moins. L’étroitesse du chenal ne permet pas d’explorer l’estomac d’aval.
9. Les perspectives
Il faut respecter strictement les indications :
1. Obésité massive (IMC > 40 kg/(m)2 ou fortement compliquée
2. Echec d’un traitement médical et diététique bien conduit (un an au moins de suivi)
3. Consultation d’endocrinologie ou de Nutrition pour dépister une hypothyroïdie notamment
4. Consultation psychiatrique pour exclure les affections à risque d’échec ou de complications : avant tout les troubles du comportement alimentaire et les psychoses et pour préparer les malades aux conséquences, inconfortables, d’une telle réduction du volume gastrique (aucun repas vrai n’est plus possible)
5. Consultation diététique à telle fin de préparer le malade au régime qu’il aura à suivre ensuite
Il faut continuer à évaluer cette chirurgie bariatrique gastrique. Il faudra être plus attentif aux contre indications et à leur diagnostic : il n’est pas facile de déceler un trouble du comportement alimentaire chez l’obèse. On sait que ces troubles touchent le plus souvent des femmes (70 % des cas) et ce sont elles qu’on opère le plus souvent (plus de 75 % des cas). De même, il faudrait déceler et traiter les troubles du comportement alimentaire après l’opération. Il faudrait pouvoir les prédire. Ce ne sera pas facile.
Il faudra aussi faire évoluer l’alimentation de ces malades qui ne peuvent plus s’alimenter comme avant, pour éviter les carences en eau, protéines, minéraux, vitamines et oligo-éléments. Des suppléments (liquides) devraient peut-être être prescrits d’emblée.
Il faut enfin veiller à éviter leur exclusion sociale ou familiale.
10. Conclusion
La prise en charge médicale de l’obésité est décourageante pour bien des malades et leurs médecins. Mais la chirurgie ne règle pas le problème. La préparation à l’intervention est l’opportunité de modifier le comportement du malade face à l’alimentation et de travailler avec lui sur l’avenir.
Après l’intervention, ce ne sera plus la même diététique, mais il devra y avoir des conseils sur les apports, les suppléments et le comportement alimentaire.
La chirurgie bariatrique ne peut être, à elle seule, une fin en soi. C’est au mieux le début d’autre chose.
Tableau I : Complications de l'obésité cardio-vasculaire, selon le type d'obésité
|
Obésité androïde (abdomino-mésentérique)
|
Obésité gynoïde (fessio-crurale)
|
|
Maladies cardio-vasculaires : coronaropathies troubles du rythme
Complications respiratoires :
insulino-résistance
Complications post-opératoires : Lâchage de sutures, éventrations, hernie hiatale, phlébite et embolie pulmonaire, infections, phlébite et embolie pulmonaire
|
Arthropathies gonarthrose
varices, phlébite, thrombose, 2 fois moins de complications respiratoires
4 fois moins de complications métaboliques
Phlébite et embolie pulmonaire (+++), lâchage de sutures, éventrations, hernie hiatale
|
| Complications cutanées : hypertension, mycose, lymphoedème et aussi : discrimination sociale, altération de l'image de soi et de la qualité de vie |
|
Tableau II : Perte de poids après chirurgie de l'obésité
|
|
Intervention
|
N
|
Suivi
|
kg perdus
|
% de l’excès
de poids perdu |
IMC avant
|
IMC après
|
| Szold et al (15) |
AGA
|
715
|
2 ans
|
43,3
|
32,1
|
||
| Dargent et al (12) |
AGA
|
500
|
2 ans
|
65 (56 % à 1 an)
|
43
|
||
| Forsell et al (19) |
AGA
|
326
|
2.5 ans
|
68
|
|||
| Doldi et al (2) |
AGA
|
172
|
3 ans
|
30% |
62.5
|
||
| Weiner et al (14) |
AGA
|
101
|
1 an
|
36 Kg
|
|||
| Ashy et Merdad (8) |
GPV
|
30
|
0.5 ans
|
87
|
|||
| Ashy et Merdad (8) |
AGA
|
30
|
50
|
||||
| Horchner et al (29,30) |
AGA
|
39
|
1an
|
40.9
|
33.1
|
||
| Naslund et al (9) |
AGA scopie
|
30
|
3 ans
|
47.8
|
36.9
|
||
| Naslund et al (9) |
AGA tomie
|
30
|
3 ans
|
41.9
|
37
|
||
| Nilsell et al (4) |
AGA
|
29
|
5 ans
|
43 Kg
|
|||
| Nilsell et al (4) |
GPV
|
30
|
5 ans
|
35 Kg
|
|||
| Ben-Dov et al (26) |
GPV
|
19
|
2 ans
|
28 %
|
43.3
|
31.5
|
AGA : anneau gastrique ajustable ; GPV : gastroplastie verticale. N : nombre de malades
Kg perdus : en pourcentage du poids de départ ou en kilos.
% de l’excès de poids perdu : le maximum est ici 100 % ; le poids seuil définissant le début de l’excès de poids correspond à un indice de masse corporelle de 30 kg/(m)2.
IMC (Poids divisé par le carré de la taille) : indice de masse corporelle, en kg/(m)2
Figure 1 : Evolution de l'indice de masse corporelle après anneau gastrique ou gastroplastie
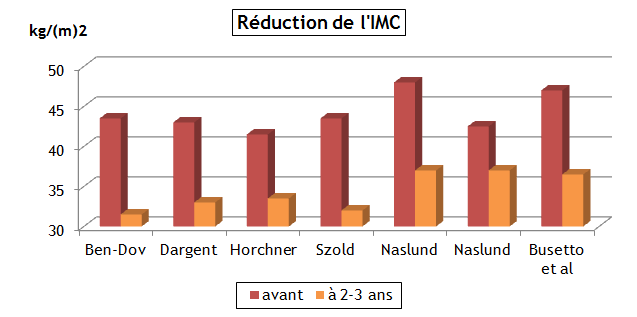
En abscisse, le nom des auteurs du travail
Figure 2 : Evolution de la composition corporelle après anneau gastrique ou gastroplastie
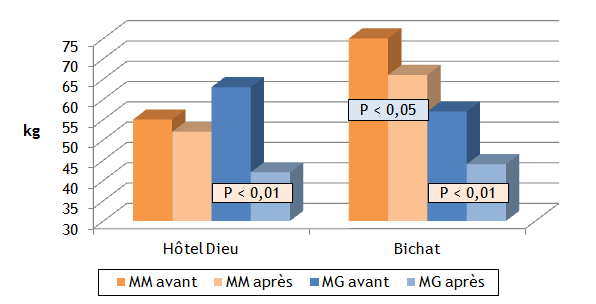
La perte de masse grasse est plus importante que la perte de masse maigre
Figure 3 : Réduction des complications associées après gastroplastie ou anneau gastrique
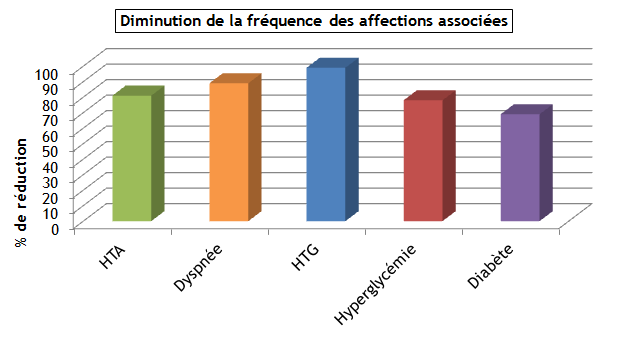
% de malades chez qui la complication a disparu
11. Bibliographie
 1. Basdevant A, Laville M. Recommandations pour la prévention et le traitement de l’obésité. Cahiers de Nutrition et de Diététique 1998;33(suppl 1):1-48
1. Basdevant A, Laville M. Recommandations pour la prévention et le traitement de l’obésité. Cahiers de Nutrition et de Diététique 1998;33(suppl 1):1-48
2. Nilsell K, Thorne A, Sjostedt S et al. Prospective randomised comparison of adjustable gastric banding and vertical banded gastroplasty for morbid obesity. Eur J Surg 2001;167:504-9
3. Hsu LK, Benotti PN, Dwyer J et al. Nonsurgical factors that influence the outcome of bariatric surgery: a review. Psychosom Med 1998;60:338-46
4. Pontiroli AE, Pizzocri P, Librenti MC et al. Laparoscopic adjustable gastric banding for the treatment of morbid (grade 3) obesity and its metabolic complications: a three-year study. J Clin Endocrinol Metab 2002;87:3555-61
5. De Luca M, de Werra C, Formato A et al. Laparotomic vs laparoscopic lap-band: 4-year results with early and intermediate complications. Obes Surg 2000;10:266-8
6. Dargent J. Laparoscopic adjustable gastric banding: lessons from the first 500 patients in a single institution. Obes Surg 1999;9:446-52
7. Szold A, Abu-Abeid S. Laparoscopic adjustable silicone gastric banding for morbid obesity: results and complications in 715 patients. Surg Endosc 2002;16:230-3
8. Higa KD, Boone KB, Ho T et al. Laparoscopic Roux-en-Y gastric bypass for morbid obesity: technique and preliminary results of our first 400 patients. Arch Surg 2000;135:1029-33
9. Fielding GA, Rhodes M, Nathanson LK. Laparoscopic gastric banding for morbid obesity. Surgical outcome in 335 cases. Surg Endosc 1999;13:550-4
10. Miller K, Hell E. Laparoscopic adjustable gastric banding: a prospective 4-year follow-up study. Obes Surg 1999;9:183-7
11. Kalfarentzos F, Dimakopoulos A, Kehagias I et al. Vertical banded gastroplasty versus standard or distal Roux-en-Y gastric bypass based on specific selection criteria in the morbidly obese: preliminary results. Obes Surg 1999;9:433-42
12. Kriwanek S, Blauensteiner W, Lebisch E et al. Dietary changes after vertical banded gastroplasty. Obes Surg 2000;10:37-40
13. Powers PS, Perez A, Boyd F, Rosemurgy A. Eating pathology before and after bariatric surgery: a prospective study. Int J Eat Disord 1999;25:293-300
14. Horchner R, Tuinebreijer W, Kelder H. Eating patterns in morbidly obese patients before and after a gastric restrictive operation. Obes Surg 2002;12:108-12
15. Guisado JA, Vaz FJ, Lopez-Ibor JJ Jr, Rubio MA. Eating behavior in morbidly obese patients undergoing gastric surgery: differences between obese people with and without psychiatric disorders. Obes Surg 2001;11:576-80
16. Rand CS, Macgregor AM, Stunkard AJ. The night eating syndrome in the general population and among postoperative obesity surgery patients. Int J Eat Disord 1997;22:65-9
17. Westling A, Gustavsson S. Laparoscopic vs open Roux-en-Y gastric bypass: a prospective, randomized trial. Obes Surg 2001;11:284-92
18. Wittgrove AC, Clark GW. Laparoscopic gastric bypass, Roux-en-Y- 500 patients: technique and results, with 3-60 month follow-up. Obes Surg 2000;10:233-9
19. Yale CE. Gastric surgery for morbid obesity. Complications and long-term weight control. Arch Surg 1989;124:941-6
Publié en 2004
